- Геном і CRISPR: як працює редагування ДНК зсередини
- Геном людини: масштаб задачі
- Від читання до редагування: коротка хронологія
- Як CRISPR знаходить потрібний ген
- Напрямна РНК — «GPS-навігатор»
- Білок Cas9 — «молекулярні ножиці»
- Що відбувається після розрізу
- Три покоління CRISPR-інструментів
- Перше покоління: класичний CRISPR/Cas9
- Друге покоління: base editing
- Третє покоління: prime editing
- Нецільові ефекти: головний виклик
- Як вчені борються з нецільовими ефектами
- Доставка CRISPR у клітини: ключова проблема
- Ex vivo: редагування поза організмом
- In vivo: редагування всередині організму
- CRISPR у медицині: що вже працює
- Захворювання крові
- Онкологія
- Спадкові захворювання
- CRISPR поза медициною
- Сільське господарство
- Діагностика захворювань
- Біотехнології та промисловість
- Генний драйв: технологія, що змінює екосистеми
- Ксенотрансплантація: органи від тварин для людей
- Епігеном: редагування без зміни ДНК
- Скільки коштує CRISPR
- Етика та регулювання
- Соматичне vs зародкове редагування
- Нерівність доступу
- Що далі: горизонти 2025–2030
- Ключові цифри
- Чому це важливо для кожного
Геном і CRISPR: як працює редагування ДНК зсередини
Людський геном — це 3,2 мільярда пар нуклеотидів, записаних у кожній клітині вашого тіла. Ще двадцять років тому ми лише завершили його прочитання. Сьогодні ми вміємо його переписувати. CRISPR перетворив геном із незмінного тексту на редагований документ, і це змінює все — від медицини до сільського господарства.
У першій статті ми розповіли, що таке CRISPR і чому він став революцією. Тепер час зануритися глибше. Як саме ця технологія знаходить потрібний ген серед мільярдів «літер»? Що відбувається з клітиною після редагування? І чому вчені кажуть, що ми стоїмо лише на початку?
Геном людини: масштаб задачі
Щоб зрозуміти, чому CRISPR — це прорив, потрібно уявити масштаб геному. Якщо записати весь генетичний код людини звичайним шрифтом, знадобиться 262 000 сторінок тексту. Це приблизно 175 товстих книг. І серед цього тексту потрібно знайти та виправити одну конкретну «літеру».
Геном людини складається з 23 пар хромосом. Кожна хромосома — це одна довга молекула ДНК, щільно скручена навколо білків-гістонів. Усього в геномі приблизно 20 000–25 000 генів, які кодують білки. Але гени займають лише близько 1,5% усієї ДНК.
Решта 98,5% довгий час називали «сміттєвою ДНК» (junk DNA). Сьогодні ми знаємо, що ця назва була помилковою. Значна частина некодуючої ДНК виконує регуляторні функції — вмикає та вимикає гени, контролює час і місце їхньої активності. Саме мутації в цих регуляторних ділянках часто спричиняють захворювання.
Від читання до редагування: коротка хронологія
Шлях від розшифрування геному до його редагування зайняв менше двадцяти років. Ось ключові віхи цього шляху:
| Рік | Подія | Значення |
|---|---|---|
| 2003 | Завершення проєкту «Геном людини» | Перше повне прочитання людського геному. Проєкт тривав 13 років і коштував $2,7 млрд |
| 2007 | Доведено захисну функцію CRISPR у бактерій | Вчені з компанії Danisco експериментально підтвердили, що CRISPR — це імунна система бактерій |
| 2012 | Створення інструменту CRISPR/Cas9 | Шарпентьє та Дудна показали, що систему можна запрограмувати на розрізання будь-якої ДНК |
| 2013 | CRISPR працює в клітинах людини | Групи Чжана та Черча довели ефективність технології у клітинах ссавців |
| 2016 | Винайдено base editing | Девід Лю створив інструмент для заміни окремих «літер» ДНК без розрізання обох ланцюгів |
| 2019 | Винайдено prime editing | Ще точніший інструмент — «пошук і заміна» для генетичного коду |
| 2020 | Нобелівська премія з хімії | Шарпентьє та Дудна отримали найвищу наукову нагороду за CRISPR/Cas9 |
| 2023 | Схвалення Casgevy (exa-cel) | Перший у світі CRISPR-препарат для лікування серпоподібноклітинної анемії та бета-таласемії |
За десять років CRISPR пройшов шлях від лабораторної ідеї до схваленого лікарського засобу. Для порівняння: антибіотикам знадобилося понад 15 років від відкриття пеніциліну до масового виробництва.
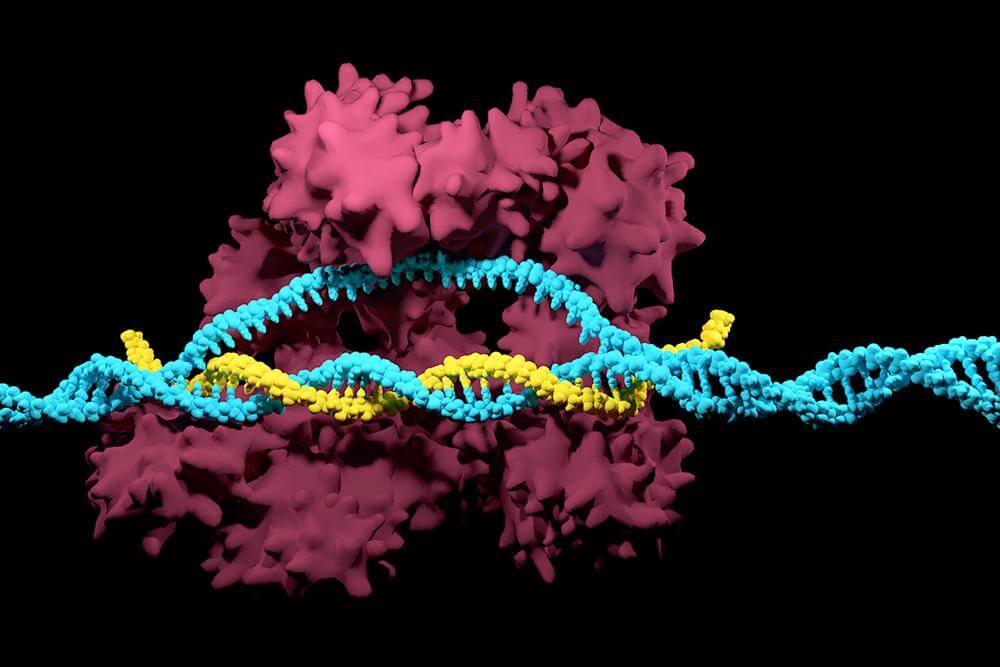
Як CRISPR знаходить потрібний ген
Механізм роботи CRISPR/Cas9 елегантний у своїй простоті. Система складається з двох ключових компонентів, і кожен виконує свою чітку роль.
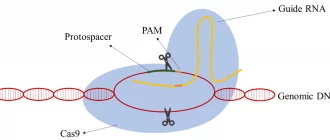
Напрямна РНК — «GPS-навігатор»
Напрямна РНК (guide RNA, або gRNA) — це коротка молекула довжиною приблизно 20 нуклеотидів. Вона комплементарна (тобто точно відповідає) тій ділянці ДНК, яку потрібно знайти. Напрямна РНК «сканує» геном, ковзаючи вздовж ланцюга ДНК, доки не знайде ідеальний збіг.
Цей процес нагадує пошук слова в книзі. Ви знаєте, яке слово шукаєте, і перевіряєте сторінку за сторінкою, поки не знайдете точний збіг. Різниця в тому, що CRISPR робить це на молекулярному рівні — серед мільярдів нуклеотидів.
Білок Cas9 — «молекулярні ножиці»
Cas9 — це фермент-ендонуклеаза, який фізично розрізає обидва ланцюги подвійної спіралі ДНК. Він активується лише тоді, коли напрямна РНК знаходить свою мішень. Додаткова умова — поруч із мішенню має бути коротка послідовність PAM (Protospacer Adjacent Motif). Для найпоширенішого варіанту Cas9 зі Streptococcus pyogenes ця послідовність — NGG (де N — будь-який нуклеотид).
PAM-послідовність виконує роль «перевірки безпеки». Вона гарантує, що Cas9 розріже ДНК лише у правильному місці. Без PAM фермент не активується, навіть якщо напрямна РНК знайшла збіг.
Що відбувається після розрізу
Коли Cas9 розрізає обидва ланцюги ДНК, клітина активує механізми репарації — «ремонту» пошкодженої ДНК. Існують два основних шляхи:
- NHEJ (Non-Homologous End Joining) — негомологічне з’єднання кінців. Клітина просто «зшиває» розрізані кінці. Цей процес неточний і часто вносить невеликі вставки або видалення нуклеотидів. Результат — ген «ламається» і перестає працювати. Це корисно, коли потрібно вимкнути дефектний або шкідливий ген
- HDR (Homology-Directed Repair) — репарація за гомологією. Якщо вчені надають клітині «шаблон» — фрагмент ДНК із правильною послідовністю, — клітина використає його як зразок для ремонту. Це дозволяє точно замінити мутантну послідовність на нормальну
Вибір між NHEJ та HDR залежить від типу клітини, фази клітинного циклу та наявності шаблону. У клітинах, що активно діляться, HDR працює ефективніше. У постмітотичних клітинах (наприклад, нейронах) переважає NHEJ.
Три покоління CRISPR-інструментів
Класичний CRISPR/Cas9 — це лише перший крок. За останнє десятиліття вчені створили цілий арсенал інструментів, кожен із яких вирішує конкретні задачі точніше та безпечніше.
Перше покоління: класичний CRISPR/Cas9
Класична система розрізає обидва ланцюги ДНК. Це ефективно, але грубо. Подвійний розрив — це серйозне пошкодження, яке клітина сприймає як аварію. Іноді репарація відбувається з помилками, що призводить до небажаних мутацій.
Класичний CRISPR/Cas9 найкраще підходить для «вимкнення» генів (нокаут) або для вставки великих фрагментів ДНК. Він залишається основним інструментом у фундаментальних дослідженнях, де потрібно швидко та дешево модифікувати геном модельних організмів.
Друге покоління: base editing
У 2016 році група Девіда Лю з Гарвардського університету створила принципово новий підхід. Base editors («редактори основ») не розрізають обидва ланцюги ДНК. Замість цього вони хімічно перетворюють одну нуклеотидну основу на іншу безпосередньо в ланцюзі ДНК.
Існують два типи base editors:
- CBE (Cytosine Base Editor) — перетворює пару C·G на T·A
- ABE (Adenine Base Editor) — перетворює пару A·T на G·C
Разом ці два інструменти можуть виправити близько 60% усіх відомих патогенних точкових мутацій у людини. Це величезний крок уперед, адже більшість генетичних захворювань спричинені саме заміною однієї «літери» в генетичному коді.
Третє покоління: prime editing
У 2019 році та сама група Девіда Лю представила prime editing — найточніший інструмент на сьогодні. Його називають «пошук і заміна» для ДНК, за аналогією з функцією текстового редактора.
Prime editor використовує модифікований білок Cas9, який розрізає лише один ланцюг ДНК (ніказа), та спеціальну РНК (pegRNA), яка одночасно вказує мішень і містить шаблон для редагування. Система здатна вносити будь-які точкові заміни, невеликі вставки та видалення — без подвійного розриву ДНК та без зовнішнього донорського шаблону.
Теоретично prime editing може виправити до 89% відомих генетичних варіантів, пов’язаних із захворюваннями людини. На практиці ефективність поки що нижча, ніж у класичного CRISPR, але технологія швидко вдосконалюється.
Нецільові ефекти: головний виклик
Жоден інструмент не є ідеальним. Найбільша проблема CRISPR — нецільові мутації (off-target effects). Це ситуації, коли система розрізає ДНК не лише у запланованому місці, а й у схожих послідовностях в інших частинах геному.
Геном людини містить мільярди нуклеотидів, і статистично в ньому існують ділянки, схожі на мішень. Якщо напрямна РНК «помиляється» і зв’язується з такою ділянкою, Cas9 може розрізати ДНК у неправильному місці. Наслідки варіюються від нешкідливих до потенційно небезпечних — включаючи порушення роботи важливих генів або активацію онкогенів.
Як вчені борються з нецільовими ефектами
За останні роки розроблено кілька стратегій для підвищення точності:
- Високоточні варіанти Cas9 — eSpCas9, HiFi Cas9, Cas9-HF1. Ці модифіковані ферменти мають знижену здатність зв’язуватися з неідеально комплементарними послідовностями
- Скорочені напрямні РНК — зменшення довжини gRNA з 20 до 17–18 нуклеотидів парадоксально підвищує специфічність, оскільки коротша РНК менш толерантна до невідповідностей
- Альтернативні нуклеази — Cas12a (Cpf1), Cas12b та інші ферменти з іншими вимогами до PAM та іншим механізмом розрізання
Крім того, сучасні біоінформатичні інструменти дозволяють заздалегідь передбачити потенційні нецільові сайти та обрати напрямну РНК із мінімальним ризиком помилок.
Доставка CRISPR у клітини: ключова проблема
Створити ідеальний інструмент — це лише половина справи. Потрібно ще доставити його до потрібних клітин в організмі. Проблема доставки залишається одним із найбільших технічних бар’єрів на шляху до широкого клінічного застосування CRISPR.
Ex vivo: редагування поза організмом
Найпростіший підхід — вилучити клітини з організму, відредагувати їх у лабораторії та повернути назад. Саме так працює Casgevy — перший схвалений CRISPR-препарат. У пацієнта відбирають стовбурові клітини крові, редагують їх і повертають після хіміотерапії.
Цей підхід надійний, але обмежений. Він працює лише для клітин, які можна вилучити та повернути — переважно клітин крові та імунних клітин. Для лікування захворювань печінки, мозку або м’язів потрібні інші методи.
In vivo: редагування всередині організму
Доставка CRISPR безпосередньо в клітини живого організму — значно складніша задача. Основні методи:
- Адено-асоційовані віруси (AAV) — невеликі віруси, які ефективно проникають у клітини, але мають обмежену ємність (близько 4,7 кілобаз ДНК). Ген Cas9 зі Streptococcus pyogenes займає 4,2 кілобази, тому залишається мало місця для напрямної РНК та регуляторних елементів
- Ліпідні наночастинки (LNP) — штучні «бульбашки» з ліпідів, які доставляють мРНК Cas9 та напрямну РНК. Ця технологія добре зарекомендувала себе під час пандемії COVID-19 для доставки мРНК-вакцин. Компанія Intellia Therapeutics використовує LNP для доставки CRISPR у клітини печінки
- Вірусоподібні частинки (VLP) — гібридний підхід, що поєднує ефективність вірусної доставки з безпекою невірусних методів
Кожен метод має свої переваги та обмеження. Ідеальна система доставки повинна бути ефективною, специфічною (потрапляти лише в потрібні клітини), безпечною та масштабованою для виробництва.
CRISPR у медицині: що вже працює
Станом на 2025 рік у світі зареєстровано понад 80 клінічних випробувань із застосуванням CRISPR-терапій. Ось найважливіші напрямки.
Захворювання крові
Casgevy (exa-cel) від компанії Vertex Pharmaceuticals та CRISPR Therapeutics — перший і поки єдиний схвалений CRISPR-препарат. Він лікує серпоподібноклітинну анемію та бета-таласемію шляхом активації фетального гемоглобіну. Клінічні дані вражають: 97% пацієнтів із серпоподібноклітинною анемією не мали больових кризів протягом щонайменше 12 місяців після лікування.
Вартість лікування становить приблизно $2,2 млн за одного пацієнта. Це дорого, але серпоподібноклітинна анемія потребує довічного лікування, яке за все життя може коштувати ще більше.
Онкологія
CRISPR активно використовують для вдосконалення CAR-T терапії — методу, при якому імунні клітини пацієнта (Т-лімфоцити) генетично модифікують для розпізнавання та знищення пухлинних клітин. CRISPR дозволяє одночасно вносити кілька змін у Т-клітини: додавати рецептор для розпізнавання пухлини, видаляти гени, які гальмують імунну відповідь, та підвищувати стійкість клітин до імуносупресивного середовища пухлини.
Компанія Caribou Biosciences проводить клінічні випробування алогенних (від донора) CAR-T клітин, відредагованих за допомогою CRISPR. Це може зробити CAR-T терапію доступнішою, оскільки не потрібно створювати індивідуальний препарат для кожного пацієнта.
Спадкові захворювання
Компанія Intellia Therapeutics проводить клінічні випробування CRISPR-терапії для лікування транстиретинового амілоїдозу — захворювання, при якому мутантний білок транстиретин накопичується в органах і руйнує їх. Одноразова ін’єкція ліпідних наночастинок із CRISPR-компонентами знижує рівень мутантного білка в крові на 87–93%.
Це перший приклад успішного застосування CRISPR in vivo — безпосередньо в організмі пацієнта, без вилучення клітин. Результати відкривають шлях до лікування десятків інших захворювань печінки.
CRISPR поза медициною
Медицина — найгучніший, але далеко не єдиний напрямок застосування CRISPR. Технологія трансформує цілі галузі.
Сільське господарство
CRISPR дозволяє створювати нові сорти рослин за місяці замість десятиліть, які потрібні для традиційної селекції. Ключова перевага: у багатьох випадках CRISPR-модифіковані рослини не містять чужорідної ДНК, тому в США, Японії, Аргентині та Бразилії вони не підпадають під регулювання ГМО.
Приклади вже комерціалізованих продуктів:
- Помідори Sicilian Rouge High GABA (Японія, 2021) — містять у 4–5 разів більше амінокислоти GABA, яка сприяє зниженню кров’яного тиску
- Гірчична олія з підвищеним вмістом олеїнової кислоти (США) — здоровіша альтернатива звичайній олії
- Пшениця зі зниженим вмістом глютену — для людей із целіакією
У перспективі CRISPR може допомогти створити культури, стійкі до посухи, засолення ґрунтів та нових хвороб. Це критично важливо в умовах зміни клімату та зростання населення планети.
Діагностика захворювань
CRISPR використовують не лише для редагування, а й для виявлення ДНК та РНК. Системи SHERLOCK (на основі Cas13) та DETECTR (на основі Cas12) здатні виявляти специфічні генетичні послідовності з надзвичайною чутливістю — до одиничних молекул.
Під час пандемії COVID-19 ці системи дозволили створити швидкі діагностичні тести, які визначали наявність вірусу SARS-CoV-2 за 20–40 хвилин. У майбутньому CRISPR-діагностика може стати основою для портативних пристроїв, здатних виявляти інфекції, онкомаркери та генетичні мутації безпосередньо біля ліжка пацієнта.
Біотехнології та промисловість
CRISPR прискорює розробку нових ферментів, біопалива та біоматеріалів. Вчені модифікують мікроорганізми для виробництва цінних сполук — від фармацевтичних субстанцій до біорозкладних пластиків. Це напрямок, який називають синтетичною біологією, і CRISPR є одним із його головних інструментів.
Генний драйв: технологія, що змінює екосистеми
Одне з найамбітніших та найсуперечливіших застосувань CRISPR — генний драйв (gene drive). Це механізм, який дозволяє поширити генетичну модифікацію на всю популяцію дикого виду протягом кількох поколінь.
У звичайному спадкуванні ген передається 50% нащадків. Генний драйв «обманює» цей механізм: модифікований ген копіює себе на парну хромосому, і його успадковують майже 100% нащадків. За кілька поколінь модифікація поширюється на всю популяцію.
Головна мета — боротьба з малярією. Щороку від малярії помирає понад 600 000 людей, переважно діти в Африці. Вчені розробляють генний драйв для комарів роду Anopheles, який або робить їх стійкими до малярійного паразита, або знижує їхню здатність до розмноження.
Однак генний драйв — це незворотна зміна дикої природи. Наслідки для екосистеми непередбачувані. Що станеться, якщо зникне цілий вид комарів? Як це вплине на тварин, які ними живляться? Ці питання потребують ретельного вивчення перед будь-яким польовим випробуванням.
Ксенотрансплантація: органи від тварин для людей
Дефіцит донорських органів — глобальна проблема. Щороку тисячі людей помирають, не дочекавшись трансплантації. CRISPR відкриває шлях до ксенотрансплантації — пересадки органів від тварин (насамперед свиней) людям.
Свині — ідеальні кандидати: їхні органи за розміром подібні до людських, а тварини швидко розмножуються. Проблема в тому, що геном свині містить ендогенні ретровіруси (PERV) та гени, які спричиняють відторгнення органів імунною системою людини.
За допомогою CRISPR вчені одночасно інактивували 62 копії PERV у геномі свині — рекордна кількість редагувань в одному організмі. Також видалено гени, що кодують антигени, які викликають гіперімунну відповідь, та додано людські гени для покращення сумісності.
У 2022 році було проведено першу трансплантацію серця від генетично модифікованої свині людині. Пацієнт прожив два місяці. У 2024 році ще кілька пацієнтів отримали свинячі нирки. Результати поки що неоднозначні, але технологія швидко вдосконалюється.
Епігеном: редагування без зміни ДНК
Не завжди потрібно змінювати сам генетичний код. Іноді достатньо змінити те, як клітина «читає» цей код. Це сфера епігенетичного редагування — одного з найперспективніших напрямків розвитку CRISPR.
Епігеном — це сукупність хімічних модифікацій ДНК та гістонів, які визначають, які гени активні в конкретній клітині. Метилування ДНК, ацетилування гістонів, інші модифікації — усе це впливає на експресію генів, не змінюючи самої послідовності нуклеотидів.
Системи CRISPRi (інтерференція) та CRISPRa (активація) використовують модифікований білок dCas9, який не розрізає ДНК, а лише зв’язується з нею. До dCas9 приєднують ефекторні домени, які пригнічують або активують транскрипцію гена-мішені.
Перевага епігенетичного редагування — зворотність. На відміну від класичного CRISPR, зміни в епігеномі можуть бути тимчасовими. Це особливо цінно для терапії, де потрібно тимчасово змінити активність гена, а не назавжди переписати його.
Скільки коштує CRISPR
Одна з головних причин революційності CRISPR — його доступність. Порівняймо вартість різних підходів до редагування генів:
| Параметр | ZFN | TALEN | CRISPR/Cas9 |
|---|---|---|---|
| Вартість одного експерименту | $5 000 – $10 000 | $1 000 – $3 000 | $30 – $50 |
| Час підготовки | Місяці | Тижні | Дні |
| Необхідна кваліфікація | Вузький спеціаліст | Досвідчений молекулярний біолог | Базова підготовка |
| Мультиплексне редагування | Дуже складно | Складно | Відносно просто |
Зниження вартості у 100–300 разів порівняно з попередніми методами зробило генне редагування доступним для тисяч лабораторій по всьому світу. Це демократизація, порівнянна з появою персональних комп’ютерів у 1980-х роках.
Водночас клінічне застосування CRISPR залишається дорогим. Лікування Casgevy коштує $2,2 млн. Розробка нової CRISPR-терапії від лабораторії до клініки потребує $500 млн – $1 млрд та 8–12 років. Зниження цих витрат — одне з головних завдань галузі.
Етика та регулювання
Потужність CRISPR ставить перед суспільством питання, на які немає простих відповідей. Де межа між лікуванням та «покращенням» людини? Хто має право редагувати геном ембріона? Як запобігти зловживанням?
Соматичне vs зародкове редагування
Наукова спільнота розрізняє два типи генного редагування:
- Соматичне редагування — зміни в клітинах тіла дорослої людини. Ці зміни не передаються нащадкам. Більшість вчених та регуляторів підтримують цей підхід для лікування тяжких захворювань
- Зародкове редагування — зміни в яйцеклітинах, сперматозоїдах або ембріонах. Ці зміни передаються всім наступним поколінням. У більшості країн діє фактичний мораторій на клінічне застосування
Справа Хе Цзянькуя у 2018 році — коли китайський вчений створив перших генетично відредагованих дітей — показала, що технічна можливість випереджає етичне та правове регулювання. Після цього випадку міжнародна спільнота посилила зусилля з розробки глобальних правил.
Нерівність доступу
Якщо CRISPR-терапії коштуватимуть мільйони, вони будуть доступні лише заможним країнам та людям. Це може створити нову форму нерівності — генетичну нерівність. Захворювання, які можна вилікувати, залишатимуться невиліковними для тих, хто не може собі дозволити лікування.
Ця проблема особливо гостра для серпоподібноклітинної анемії, яка найбільше поширена в країнах Африки та Південної Азії — регіонах із найнижчим рівнем доходів.
Що далі: горизонти 2025–2030
Технологія CRISPR розвивається стрімко. Ось напрямки, які визначатимуть найближче майбутнє:
Нові CRISPR-терапії. Очікується схвалення препаратів для лікування транстиретинового амілоїдозу, спадкового ангіоневротичного набряку, серпоподібноклітинної анемії (in vivo підхід, без хіміотерапії). Десятки інших терапій перебувають на різних стадіях клінічних випробувань.
Ксенотрансплантація. Перші контрольовані клінічні випробування пересадки свинячих органів людям можуть розпочатися до 2027 року. Це потенційно вирішить проблему дефіциту донорських органів.
CRISPR-діагностика. Портативні діагностичні пристрої на основі CRISPR можуть з’явитися у клінічній практиці вже найближчими роками. Вони дозволять швидко виявляти інфекції, генетичні мутації та онкомаркери без складного лабораторного обладнання.
Епігенетичне редагування. Зворотне «вмикання» та «вимикання» генів без зміни ДНК може стати новим стандартом терапії для захворювань, де потрібен тимчасовий ефект.
Персоналізована медицина. У перспективі CRISPR може стати основою для індивідуальних терапій, розроблених під конкретного пацієнта та його унікальний набір мутацій. Вартість секвенування геному вже впала нижче $200, що робить генетичну діагностику масово доступною.
Ключові цифри
| Показник | Значення |
|---|---|
| Розмір геному людини | 3,2 млрд пар нуклеотидів |
| Кількість генів людини | 20 000 – 25 000 |
| Частка кодуючої ДНК | ~1,5% |
| Точкові мутації, які може виправити base editing | ~60% |
| Генетичні варіанти, які може виправити prime editing | ~89% |
| Клінічні випробування CRISPR-терапій (2025) | Понад 80 |
| Вартість лікування Casgevy | ~$2,2 млн |
| Ефективність Casgevy при серпоподібноклітинній анемії | 97% без больових кризів |
| Вартість базового CRISPR-експерименту | Від $30 |
Чому це важливо для кожного
CRISPR — це не абстрактна наука. Це технологія, яка вже змінює життя реальних людей. Пацієнти з серпоподібноклітинною анемією, які все життя страждали від нестерпного болю, тепер живуть без кризів. Фермери отримують нові сорти рослин, стійкі до хвороб. Діагностичні тести стають швидшими та точнішими.
Але найважливіше — CRISPR ставить перед нами питання, які стосуються кожного. Чи маємо ми право змінювати геном майбутніх поколінь? Як забезпечити рівний доступ до генних терапій? Де межа між лікуванням та «вдосконаленням»?
Ці питання не мають простих відповідей. Але від того, як ми на них відповімо, залежить майбутнє не лише медицини, а й самого людства. І чим більше людей розуміють, що таке CRISPR і як він працює, тим кращими будуть ці відповіді.