- Вікторія Грей: перша пацієнтка, яка отримала CRISPR-терапію
- CRISPR 1.0: перше покоління генного редагування
- Як працювало лікування Вікторії Грей
- Понад 50 клінічних досліджень по всьому світу
- Casgevy: перший CRISPR-препарат, схвалений для продажу
- Ціна та доступність
- Обмеження першого покоління CRISPR-терапії
- Складна процедура
- Проблема доставки
- «Геномний вандалізм»
- Ризики клінічних випробувань
- CRISPR 2.0: базове та праймове редагування
- Базове редагування (Base Editing)
- Праймове редагування (Prime Editing)
- Клінічні випробування CRISPR 2.0
- Прорив 2025 року: персоналізована CRISPR-терапія для немовляти
- Тисячі хвороб без лікування: проблема комерційної вигоди
- Виклики для CRISPR-індустрії у 2025–2026 роках
- Порівняння поколінь CRISPR-технологій
- Що це означає для звичайних людей
- Часті запитання (FAQ)
- Що таке CRISPR простими словами?
- Чи безпечна CRISPR-терапія?
- Скільки коштує лікування CRISPR?
- Чим відрізняється CRISPR 2.0 від CRISPR 1.0?
- Коли CRISPR зможе лікувати більше захворювань?
CRISPR 2.0: Забудьте про дизайнерських немовлят — ось як CRISPR насправді змінює життя людей
Технологія редагування генів CRISPR пройшла шлях від лабораторного інструменту до першого схваленого генного лікування у грудні 2023 року. Сьогодні понад 50 клінічних досліджень тестують CRISPR на добровольцях по всьому світу. А наступне покоління — базове та праймове редагування — обіцяє ще точніші й безпечніші терапії.
Ця стаття розповідає про реальних людей, чиє життя змінив CRISPR, про перше схвалене лікування Casgevy, про обмеження першого покоління технології та про те, що чекає на нас у найближчі роки.
Вікторія Грей: перша пацієнтка, яка отримала CRISPR-терапію
Коли ви чуєте про редагування генів, забудьте про Хе Цзянькуя — китайського вченого, який у 2018 році створив генетично модифікованих немовлят. Натомість подумайте про Вікторію Грей — 34-річну жінку з Форест, штат Міссісіпі, яка все життя страждала від серпоподібноклітинної анемії.
Серпоподібноклітинна анемія (англ. sickle cell disease) — це спадкове захворювання крові, при якому еритроцити набувають деформованої серпоподібної форми. Такі клітини закупорюють судини, погано переносять кисень і спричиняють нестерпний біль, анемію та пошкодження органів. У США від цієї хвороби страждають близько 100 000 людей, переважно афроамериканці.
У 2019 році Грей стала першою людиною у США, яка отримала CRISPR-терапію для лікування генетичного захворювання. Процедуру провели в Інституті досліджень Сари Кеннон у Нешвіллі, штат Теннессі. Лікарі вилучили мільярди її власних стовбурових клітин крові, відредагували їх за допомогою CRISPR і повернули назад у її організм.
«Я стою перед вами сьогодні як доказ того, що дива все ще трапляються», — сказала Вікторія Грей на Третьому міжнародному саміті з редагування геному людини у Лондоні в 2023 році.
Після лікування Грей більше не мала нападів болю. Вона почала працювати, проводити час із чотирма дітьми та виступати як міжнародний адвокат пацієнтів із рідкісними захворюваннями. Свої відредаговані клітини вона називає «суперклітинами», тому що вони більше не набувають серпоподібної форми.
CRISPR 1.0: перше покоління генного редагування
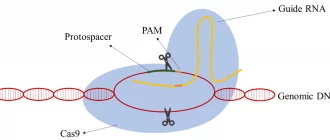
CRISPR (англ. Clustered Regularly Interspaced Short Palindromic Repeats) — це технологія, яка дозволяє програмовано змінювати ДНК. Вона працює за допомогою двох компонентів: білка-«ножиць» Cas9 та короткої генетичної послідовності, яка діє як GPS-навігатор і спрямовує ножиці до конкретного місця у хромосомах.
Як зазначила біохімік із Берклі та нобелівська лауреатка Дженніфер Даудна, заміна цієї GPS-послідовності — технічно дуже проста операція. Саме це робить CRISPR таким універсальним: один інструмент можна перепрограмувати для роботи з будь-якою ділянкою геному.
Як працювало лікування Вікторії Грей
Лікування Грей було побудоване на елегантному біологічному принципі. У кожної людини є два типи гемоглобіну: фетальний (який працює у немовлят до народження) та дорослий. При серпоподібноклітинній анемії саме дорослий гемоглобін є дефектним.
CRISPR-терапія «розрізала» певну ділянку ДНК, щоб реактивувати ген фетального гемоглобіну, який зазвичай вимикається після народження. Додаткова копія здорового гемоглобіну компенсує дефектний білок — і симптоми зникають.
Понад 50 клінічних досліджень по всьому світу
За підрахунками Девіда Лю, фахівця з генного редагування з Гарвардського університету, станом на 2023 рік у світі проводилося понад 50 клінічних досліджень із використанням генного редагування. Близько 40 із них використовували саме CRISPR. Ці дослідження охоплювали лікування раку, ВІЛ-інфекції, захворювань крові та інших патологій.
Як зазначив дослідник із Каліфорнійського університету в Берклі Федір Урнов: «Я вважаю, що CRISPR перевершив усі попередні технології генної терапії за швидкістю прогресу».
Casgevy: перший CRISPR-препарат, схвалений для продажу
У грудні 2023 року FDA (Управління з контролю за продуктами та ліками США) схвалило Casgevy (екзагамглоген аутотемцел) — перший у світі лікарський препарат на основі CRISPR/Cas9. Це стало історичним моментом для генної терапії.
Casgevy розроблений компаніями Vertex Pharmaceuticals та CRISPR Therapeutics для лікування двох захворювань:
- Серпоподібноклітинна анемія — схвалено у грудні 2023 року
- Трансфузійно-залежна бета-таласемія — схвалено у січні 2024 року
Препарат призначений для пацієнтів від 12 років. Це одноразове лікування: стовбурові клітини крові пацієнта вилучають, редагують за допомогою CRISPR для підвищення рівня фетального гемоглобіну, а потім повертають назад.
Ціна та доступність
Вартість Casgevy становить приблизно $2,2 мільйона за одноразове лікування. Станом на 2025 рік відкрито понад 50 центрів лікування у Північній Америці, Європейському Союзі та на Близькому Сході.
Висока ціна — це серйозний бар’єр. Для порівняння: інша генна терапія від бета-таласемії, розроблена компанією Bluebird Bio (препарат Zynteglo), була знята з європейського ринку після того, як уряди відмовилися платити $1,8 мільйона за лікування.
Обмеження першого покоління CRISPR-терапії
Попри революційність, CRISPR 1.0 має суттєві обмеження. Розуміння цих обмежень допомагає оцінити, чому наступне покоління технології є таким важливим.
Складна процедура
Лікування Casgevy вимагає пересадки кісткового мозку. Перед поверненням відредагованих клітин пацієнт проходить виснажливу хіміотерапію, щоб знищити існуючий кістковий мозок і звільнити місце для нових клітин. Це саме по собі серйозне випробування, і не кожен пацієнт готовий або здатний його пройти.
Vertex Pharmaceuticals вважає, що лікування підходить для «тяжких» випадків — це приблизно 32 000 людей у Європі та США.
Проблема доставки
Головною технічною перешкодою залишається доставка CRISPR у потрібні клітини організму. У випадку з Вікторією Грей лікарі вилучили кістковий мозок, відредагували його в лабораторії та повернули назад. Але для лікування інших захворювань — наприклад, хвороб серця, печінки чи мозку — потрібно доставити CRISPR безпосередньо у відповідні тканини всередині тіла.
«Геномний вандалізм»
Біолог Гарвардського університету Джордж Черч назвав перше покоління CRISPR-терапій «геномним вандалізмом». Причина проста: класичний CRISPR переважно руйнує гени, а не виправляє їх. Він розрізає ДНК у потрібному місці, але не може точно замінити одну генетичну «букву» на іншу.
За аналізом Девіда Лю, дві третини усіх клінічних досліджень CRISPR станом на 2023 рік були спрямовані саме на «руйнування» генів — вимкнення дефектних ділянок ДНК.
Ризики клінічних випробувань
Не всі дослідження завершуються успіхом. У січні 2023 року біотехнологічна компанія Graphite Bio із Сан-Франциско була змушена зупинити свої випробування CRISPR-терапії для серпоподібноклітинної анемії. У першого пацієнта рівень клітин крові впав до небезпечного рівня — і це було спричинено самим лікуванням.
Акції компанії впали більш ніж на 90%. Згодом, у листопаді 2023 року, Graphite Bio об’єдналася з компанією Lenz Therapeutics і фактично припинила роботу над CRISPR-програмами.
CRISPR 2.0: базове та праймове редагування
Наступне покоління CRISPR-технологій вирішує головну проблему першого покоління. Замість того, щоб розрізати ДНК, нові інструменти точно переписують генетичний код без створення розривів у подвійній спіралі.
Базове редагування (Base Editing)
Базовий редактор — це модифікований білок CRISPR, який не ріже ДНК, а хімічно перетворює одну генетичну «букву» на іншу. Уявіть це як гумку олівця: замість того, щоб вирізати слово зі сторінки, ви просто стираєте одну літеру і пишете іншу.
Базове редагування було розроблене в лабораторії Девіда Лю в Гарварді. Ця технологія може виконувати чотири типи замін: C→T, G→A, A→G та T→C. Це покриває приблизно 30% усіх відомих патогенних мутацій людини.
Праймове редагування (Prime Editing)
Праймовий редактор — ще потужніший інструмент, також створений у лабораторії Лю. Він може не лише замінювати окремі букви, а й вставляти або видаляти невеликі фрагменти ДНК. Це порівнюють із текстовим редактором: ви можете переписати будь-яке «слово» у генетичному коді.
За словами генетика Луїса Монтоліу з Національного центру біотехнологій Іспанії, нові версії CRISPR мають «нижчий ризик і кращу продуктивність» порівняно з класичним CRISPR/Cas9.
Клінічні випробування CRISPR 2.0
Станом на середину 2025 року щонайменше 19 клінічних досліджень тестують терапії на основі базового або праймового редагування. Сім із них уже повідомили про позитивні результати для всіх пацієнтів.
Ось ключові напрямки:
| Захворювання | Компанія / Програма | Підхід | Очікуваний термін |
|---|---|---|---|
| Серпоподібноклітинна анемія | Beam Therapeutics (BEAM-101) | Базове редагування для реактивації фетального гемоглобіну | 2026–2027 |
| Високий холестерин / хвороби серця | Verve Therapeutics (VERVE-102) | In vivo базове редагування гена PCSK9 у печінці | 2028–2030 |
| Рак (імунотерапія) | Кілька компаній | CRISPR 2.0-модифіковані Т-клітини | 2026–2028 |
| Альбінізм (проблеми зору) | Лабораторія Монтоліу (дослідження) | Базове редагування для корекції зору у новонароджених | Доклінічна стадія |
Особливо важливим є дослідження Verve Therapeutics: це перший випадок in vivo редагування генів — тобто CRISPR вводиться безпосередньо в організм пацієнта (у печінку) без вилучення клітин. Дані 2025 року показали значне зниження рівня «поганого» холестерину (ЛПНЩ). FDA надало програмі статус прискореного розгляду.
Прорив 2025 року: персоналізована CRISPR-терапія для немовляти
У червні 2025 року стався ще один історичний момент: вперше персоналізоване CRISPR-лікування було розроблено та введено немовляті всього за шість місяців — від діагнозу до терапії. Це створило регуляторний прецедент для швидкого схвалення платформних терапій для рідкісних генетичних захворювань.
Цей випадок демонструє головну перевагу CRISPR: оскільки технологію можна перепрограмувати для роботи з будь-якою ділянкою геному, теоретично можливо створити індивідуальне лікування для кожного пацієнта — навіть якщо його захворювання унікальне.
Тисячі хвороб без лікування: проблема комерційної вигоди
Попри технічні можливості, реальність CRISPR-індустрії далека від ідеальної. За словами Федіра Урнова, майже всі клінічні випробування CRISPR зосереджені лише на двох напрямках: лікування раку та серпоподібноклітинна анемія. Кілька компаній одночасно працюють над одними й тими самими проблемами.
Це означає, що тисячі інших спадкових захворювань, які теоретично можна вилікувати за допомогою CRISPR, просто ігноруються. Причина прозаїчна: більшість із них занадто рідкісні, щоб бути комерційно вигідними.
Урнов запропонував концепцію створення терапій навіть для ультра-рідкісних захворювань — включно з генетичними станами, які вражають лише одну людину у світі. Це не комерційна можливість, але це науково можливо.
«Тепер, коли генне редагування мало свої перші успіхи, існує нагальна потреба відкрити шлях до клініки для всіх», — Федір Урнов, Каліфорнійський університет у Берклі.
Виклики для CRISPR-індустрії у 2025–2026 роках
CRISPR-індустрія стикається з серйозними фінансовими труднощами. Зменшення венчурного капіталу змусило компанії звузити свої програми та зосередитися на виведенні існуючих продуктів на ринок, замість розробки нових терапій.
Це призвело до значних скорочень персоналу в CRISPR-орієнтованих компаніях та зменшення фінансування ранніх стадій досліджень. Державне фінансування біомедичних досліджень у США також суттєво скоротилося, досягнувши найнижчого рівня за десятиліття.
Водночас з’являються нові напрямки. Аутоімунні захворювання стали новою сферою застосування CRISPR у 2025 році. А ранні результати досліджень у сфері хвороб серця та редагування печінки показали надзвичайно позитивні результати.
Порівняння поколінь CRISPR-технологій
| Характеристика | CRISPR 1.0 (Cas9) | CRISPR 2.0 (базове / праймове редагування) |
|---|---|---|
| Механізм | Розрізає обидві нитки ДНК | Хімічна заміна без розрізання |
| Точність | Висока, але з побічними ефектами | Надвисока, мінімальні побічні ефекти |
| Типи змін | Вимкнення генів, великі делеції | Заміна окремих букв, вставки, видалення |
| Ризик | Небажані мутації в місці розрізу | Значно нижчий ризик |
| Перший схвалений препарат | Casgevy (грудень 2023) | Очікується 2026–2027 |
| Клінічні дослідження | ~40 (станом на 2023) | 19+ (станом на 2025) |
Що це означає для звичайних людей
CRISPR — це не про створення «дизайнерських немовлят» із блакитними очима чи високим IQ. Це про реальних людей із реальними хворобами, які вперше в історії отримують шанс на повноцінне життя.
Вікторія Грей більше не має нападів болю. Пацієнти з бета-таласемією більше не потребують регулярних переливань крові. А в найближчі роки CRISPR 2.0 може допомогти людям із хворобами серця, спадковою сліпотою та тисячами інших генетичних захворювань.
Головне питання тепер — не «чи можемо ми це зробити?», а «чи зможемо ми зробити це доступним для всіх?». Вартість у мільйони доларів, складні процедури та обмежена кількість центрів лікування — це бар’єри, які потрібно подолати, щоб революція CRISPR стала доступною не лише для обраних.
Часті запитання (FAQ)
Що таке CRISPR простими словами?
CRISPR — це молекулярний інструмент, який дозволяє вченим точно змінювати ДНК живих організмів. Він працює як «генетичні ножиці»: знаходить потрібну ділянку в геномі та вносить зміни. Технологію відкрили у 2012 році, а у 2020 році її творці — Дженніфер Даудна та Еммануель Шарпентьє — отримали Нобелівську премію з хімії.
Чи безпечна CRISPR-терапія?
Клінічні дослідження показують, що CRISPR-терапія є загалом безпечною, але не позбавленою ризиків. Основні побоювання стосуються «офф-таргет» ефектів — небажаних змін у ДНК поза цільовою ділянкою. Нове покоління технологій (базове та праймове редагування) значно знижує ці ризики, оскільки не створює розривів у ДНК.
Скільки коштує лікування CRISPR?
Casgevy, перший схвалений CRISPR-препарат, коштує приблизно $2,2 мільйона за одноразове лікування. Це одне з найдорожчих лікувань у світі. Однак прихильники технології стверджують, що одноразове лікування може бути економічно вигіднішим, ніж довічне управління хронічним захворюванням.
Чим відрізняється CRISPR 2.0 від CRISPR 1.0?
CRISPR 1.0 (класичний Cas9) розрізає ДНК, щоб вимкнути або зруйнувати ген. CRISPR 2.0 (базове та праймове редагування) точно переписує генетичний код без розрізання — як редактор тексту замість ножиць. Це безпечніше, точніше та дозволяє виправляти ширший спектр мутацій.
Коли CRISPR зможе лікувати більше захворювань?
Перші препарати на основі CRISPR 2.0 можуть бути схвалені у 2026–2027 роках. Серед пріоритетних напрямків — серпоподібноклітинна анемія (базове редагування від Beam Therapeutics), хвороби серця (Verve Therapeutics) та різні форми раку (імунотерапія модифікованими Т-клітинами).
Автор: Antonio Regalado
Джерело: https://www.technologyreview.com/2023/03/07/1069475/forget-designer-babies-heres-how-crispr-is-really-changing-lives/ (на английском)