- Коротка довідка з швидкого редагування ДНК: CRISPR/Cas9 простою мовою
- Що таке CRISPR і Cas9?
- Як відкрили CRISPR: від бактерій до Нобелівської премії
- 1987–2000: Перші знахідки
- 2002–2005: Розшифровка функції
- 2007: Експериментальне підтвердження
- 2012: Народження «генетичних ножиць»
- 2013: Від бактерій до людських клітин
- 2020: Нобелівська премія
- Як працює CRISPR/Cas9: принцип дії
- Крок 1: Програмування — створення направляючої РНК
- Крок 2: Пошук і зв’язування
- Крок 3: Розрізання
- Що відбувається після розрізу ДНК
- Негомологічне з’єднання кінців (NHEJ)
- Гомологічна рекомбінація (HDR)
- Чому CRISPR — це революція
- Застосування в медицині
- Лікування серповидноклітинної анемії та бета-таласемії
- Терапія ВІЛ
- Онкологія та інші напрямки
- Застосування в сільському господарстві
- Рослини
- Тварини
- Регулювання
- Етичні питання та випадок Хе Цзянькуя
- Скандал 2018 року
- Міжнародна позиція
- Майбутнє технології CRISPR
- Нові покоління «генетичних ножиць»
- Редагування епігеному
- Діагностика захворювань
- Перспективи
- Часті запитання (FAQ)
- Що означає абревіатура CRISPR?
- Чи безпечний CRISPR для людини?
- Чи є CRISPR-модифіковані продукти в магазинах?
- Чим CRISPR відрізняється від ГМО?
- Скільки коштує CRISPR-експеримент?
- Чи можна за допомогою CRISPR створити «суперлюдину»?
- Хто отримав Нобелівську премію за CRISPR?
Коротка довідка з швидкого редагування ДНК: CRISPR/Cas9 простою мовою
Технологія CRISPR/Cas9 дозволяє точно і швидко змінювати ДНК будь-якого живого організму. За це відкриття у 2020 році було присуджено Нобелівську премію з хімії. У цій статті розповідаємо, як працюють «генетичні ножиці», звідки вони з’явилися та чому це змінює медицину, сільське господарство і науку загалом.
Що таке CRISPR і Cas9?
CRISPR — це абревіатура від англійського Clustered Regularly Interspaced Short Palindromic Repeats, що перекладається як «кластери регулярно розташованих коротких паліндромних повторів». За цією складною назвою ховається простий принцип: це особливі ділянки ДНК бактерій, які зберігають «фоторобот» вірусів, що колись атакували клітину.
Простіше кажучи, CRISPR — це імунна пам’ять бактерій. Коли вірус заражає бактерію і та виживає, вона вирізає шматочок вірусної ДНК і вбудовує його у свій геном. Якщо той самий вірус атакує знову, бактерія «впізнає» його і знищує.
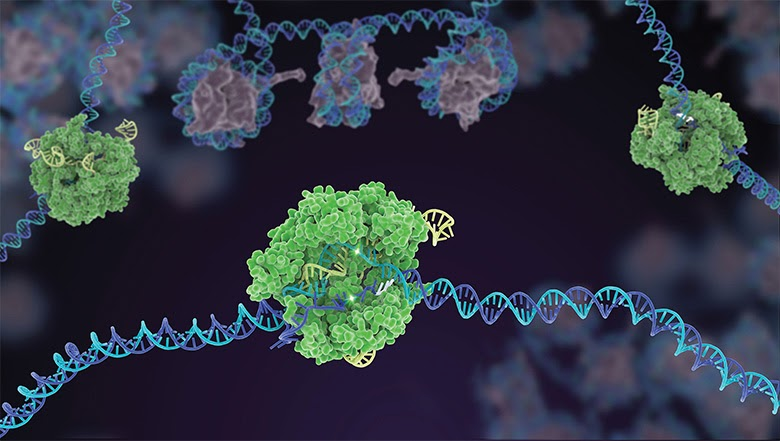
Cas9 — це білок-фермент, який виконує роль «молекулярних ножиць». Він є ендонуклеазою, тобто здатний розрізати обидві нитки двоспіральної ДНК у точно визначеному місці. Cas9 працює в парі з короткою молекулою РНК (так званою направляючою РНК, або guide RNA), яка вказує ферменту, де саме потрібно зробити розріз.
Аналогія: Уявіть текстовий документ із помилкою. Направляюча РНК — це функція «Знайти», яка знаходить потрібне слово. А Cas9 — це функція «Вирізати», яка видаляє або замінює його. Разом вони утворюють точний інструмент редагування.
Як відкрили CRISPR: від бактерій до Нобелівської премії
Історія CRISPR — це не одне раптове відкриття, а ланцюг подій, що тривав понад 25 років. Десятки вчених з різних країн крок за кроком розкривали таємниці бактеріального імунітету, навіть не підозрюючи, що створюють основу для революції в генетиці.
1987–2000: Перші знахідки
У 1987 році японський вчений Йосідзумі Ішіно з Осакського університету випадково клонував незвичайну ділянку геному кишкової палички Escherichia coli. Вона містила повторювані послідовності ДНК, розділені унікальними фрагментами. На той момент ніхто не розумів, навіщо вони потрібні.
Наприкінці 1990-х років іспанський мікробіолог Франсіско Мохіка з Університету Аліканте досліджував архебактерій, що живуть у солоній воді. Він виявив подібні паліндромні повтори в їхньому геномі, а згодом знайшов аналогічні структури у багатьох інших видів бактерій. У 2000 році Мохіка запропонував об’єднати їх під назвою SRSR, яку через два роки перейменували на CRISPR.
2002–2005: Розшифровка функції
У 2002 році група нідерландських вчених на чолі з Руудом Янсеном відкрила гени білків Cas (CRISPR-Associated), розташовані поруч із масивами CRISPR. Стало зрозуміло, що ці структури працюють як єдина система.
У 2005 році одразу три незалежні дослідницькі групи з’ясували, що спейсери (унікальні фрагменти між повторами CRISPR) ідентичні послідовностям ДНК вірусів-бактеріофагів. Мохіка сформулював гіпотезу: CRISPR — це імунна пам’ять бактерій. Його статтю спочатку відхилив журнал Nature, а потім ще кілька видань. Публікація відбулася лише через 18 місяців.
2007: Експериментальне підтвердження
Вирішальний крок зробив Філіпп Хорват з компанії Danisco (виробник йогуртів Danone). Він вивчав молочнокислі бактерії, які страждали від бактеріофагів, і довів експериментально: бактерії, що вижили після вірусної атаки, вбудовують фрагменти вірусної ДНК у свої CRISPR-масиви і стають стійкими до повторного зараження. Результати були опубліковані у журналі Science у 2007 році.
Цікавий факт: компанію Danisco згодом придбала DuPont за 6,3 мільярда доларів. Технологія CRISPR і досі використовується у виробництві молочних продуктів — йогуртів, сирів, піци.
2012: Народження «генетичних ножиць»
Переломний момент настав у 2012 році. Французька мікробіолог Еммануель Шарпентьє (на той час працювала в Університеті Умео, Швеція) та американський біохімік Дженніфер Даудна з Каліфорнійського університету в Берклі об’єднали зусилля. Вони спростили природну систему CRISPR, об’єднавши дві молекули РНК (crРНК і tracrРНК) в одну — single guide RNA (sgRNA).
У своїй статті в журналі Science вони продемонстрували, що цю спрощену систему можна запрограмувати на розрізання будь-якої заданої послідовності ДНК. Це означало, що CRISPR/Cas9 може використовуватися як універсальний інструмент редагування генів.
2013: Від бактерій до людських клітин
На початку 2013 року Фен Чжан з Інституту Broad (MIT та Гарвард) і Джордж Черч з Гарварду незалежно один від одного показали, що CRISPR/Cas9 ефективно працює в клітинах ссавців, включно з людськими. Це відкрило двері для застосування технології в медицині.
2020: Нобелівська премія
У 2020 році Еммануель Шарпентьє та Дженніфер Даудна отримали Нобелівську премію з хімії «за розробку методу редагування геному». Це була перша Нобелівська премія, яку отримали дві жінки без чоловіка-співлауреата. Від публікації ключової статті до нагороди минуло лише вісім років — надзвичайно швидко за стандартами Нобелівського комітету.
| Рік | Подія | Вчені |
|---|---|---|
| 1987 | Перше виявлення повторюваних послідовностей у ДНК бактерій | Йосідзумі Ішіно (Японія) |
| 2000 | Об’єднання подібних структур під назвою CRISPR | Франсіско Мохіка (Іспанія) |
| 2002 | Відкриття генів Cas поруч із CRISPR-масивами | Рууд Янсен (Нідерланди) |
| 2005 | Гіпотеза про CRISPR як імунну систему бактерій | Мохіка та інші групи |
| 2007 | Експериментальне підтвердження імунної функції CRISPR | Філіпп Хорват (Danisco) |
| 2012 | Створення програмованих «генетичних ножиць» CRISPR/Cas9 | Шарпентьє, Даудна |
| 2013 | Доведення ефективності CRISPR/Cas9 у клітинах ссавців | Фен Чжан, Джордж Черч |
| 2020 | Нобелівська премія з хімії за CRISPR/Cas9 | Шарпентьє, Даудна |
Як працює CRISPR/Cas9: принцип дії
Механізм роботи CRISPR/Cas9 можна описати у три кроки. Кожен з них має чітку біологічну логіку, але загалом процес нагадує роботу текстового редактора: знайти потрібний фрагмент, вирізати його, за потреби вставити новий.
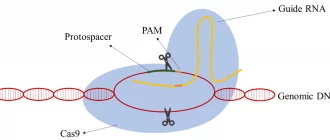
Крок 1: Програмування — створення направляючої РНК
Вчені синтезують коротку молекулу РНК довжиною приблизно 20 нуклеотидів, яка є комплементарною (дзеркально відповідною) до цільової ділянки ДНК. Ця молекула називається sgRNA (single guide RNA) — єдина направляюча РНК. Вона «вказує» білку Cas9, де саме в геномі потрібно зробити розріз.
Крок 2: Пошук і зв’язування
Комплекс sgRNA + Cas9 сканує ДНК клітини, шукаючи ділянку, що відповідає послідовності направляючої РНК. Для успішного зв’язування поруч із цільовою ділянкою має бути коротка послідовність PAM (Protospacer Adjacent Motif) — зазвичай три нуклеотиди NGG. PAM слугує «маячком», який дозволяє Cas9 відрізнити чужу ДНК від власної.
Крок 3: Розрізання
Коли sgRNA знаходить комплементарну ділянку, а Cas9 розпізнає PAM, фермент розрізає обидві нитки двоспіральної ДНК. Утворюється так званий двониточковий розрив (double-strand break, DSB). Після цього клітина запускає механізми репарації — «ремонту» ДНК.
Важливо: Послідовність із 20 нуклеотидів, як правило, є унікальною в геномі. Це забезпечує високу точність — Cas9 розрізає ДНК саме там, де потрібно, а не в довільному місці.
Що відбувається після розрізу ДНК
Молекула ДНК надзвичайно стабільна — її можна кип’ятити, і вона збережеться. Найдавніша секвенована ДНК має вік понад 1,6 мільйона років. Проте до розривів ДНК дуже чутлива: клітина негайно намагається «залатати» пошкодження. Є два основні шляхи репарації.
Негомологічне з’єднання кінців (NHEJ)
Це швидкий, але «неакуратний» спосіб ремонту. Клітина просто з’єднує розірвані кінці ДНК, але при цьому можуть бути втрачені або додані кілька нуклеотидів. Оскільки генетичний код читається триплетами (по три нуклеотиди на одну амінокислоту), навіть невелика вставка або видалення спричиняє зсув рамки зчитування. Ген перестає працювати.
Цей механізм використовують, коли потрібно «вимкнути» ген — наприклад, щоб дослідити його функцію або заблокувати ген, що спричиняє хворобу.
Гомологічна рекомбінація (HDR)
Це точніший шлях. Клітина використовує другу копію хромосоми як шаблон для відновлення пошкодженої ділянки. Вчені можуть «обманути» клітину, подавши їй штучний фрагмент ДНК із потрібною послідовністю. Клітина використає його як матрицю і вбудує нову інформацію в геном.
Цей механізм дозволяє замінювати мутантні гени на здорові або вставляти нові гени в точно визначене місце. Однак ефективність HDR поки що нижча, ніж NHEJ, і вчені активно працюють над її підвищенням.
| Параметр | NHEJ (негомологічне з’єднання) | HDR (гомологічна рекомбінація) |
|---|---|---|
| Точність | Низька — можливі вставки/видалення | Висока — точна заміна послідовності |
| Швидкість | Швидко | Повільніше |
| Потрібен шаблон? | Ні | Так — донорська ДНК |
| Застосування | «Вимкнення» генів | Заміна мутацій, вставка нових генів |
| Ефективність | Висока | Нижча, потребує оптимізації |
Чому CRISPR — це революція
До появи CRISPR/Cas9 вчені вже мали інструменти для редагування генів — нуклеази з «цинковими пальцями» (ZFN) та TALEN. Але ці методи вимагали створення індивідуального білка для кожної нової мішені. Розробка одного такого білка займала тижні або місяці і коштувала тисячі євро.
CRISPR змінив правила гри. Ось чому:
- Простота. Щоб перенацілити CRISPR на нову ділянку ДНК, достатньо змінити послідовність направляючої РНК. Синтезувати нову sgRNA можна за кілька днів.
- Дешевизна. Вартість CRISPR-реагентів становить 10–20 євро проти кількох тисяч євро за кастомні білки ZFN або TALEN.
- Швидкість. Від ідеї до клітинної лінії з потрібною мутацією може минути лише тиждень.
- Універсальність. CRISPR працює в клітинах усіх організмів — від бактерій до людини.
- Мультиплексність. Можна одночасно редагувати кілька генів, використовуючи декілька sgRNA.
Якщо порівнювати з попередніми методами, CRISPR — це як перехід від друкарської машинки до сучасного текстового редактора. Технологія зробила генну інженерію доступною для лабораторій по всьому світу.
Застосування в медицині
Медичне застосування CRISPR/Cas9 — це, мабуть, найбільш захоплюючий напрямок. Технологія відкриває можливості для лікування хвороб, які раніше вважалися невиліковними.
Лікування серповидноклітинної анемії та бета-таласемії
У грудні 2023 року Управління з контролю за продуктами та ліками США (FDA) та Європейське агентство з лікарських засобів (EMA) схвалили Casgevy (exagamglogene autotemcel) — перший у світі CRISPR-препарат для лікування серповидноклітинної анемії та трансфузійно-залежної бета-таласемії.
Принцип лікування такий:
- У пацієнта забирають стовбурові клітини кісткового мозку.
- У лабораторії за допомогою CRISPR «вимикають» ген BCL11A, який пригнічує виробництво фетального гемоглобіну.
- Фетальний гемоглобін — це форма гемоглобіну, яка активна у плода до народження. Він здатний компенсувати дефектний дорослий гемоглобін.
- Відредаговані клітини повертають пацієнту.
Результати клінічних випробувань вражають: пацієнтка з бета-таласемією, яка раніше потребувала 16 переливань крові на рік, не потребувала жодного протягом року після терапії. Аналогічний ефект спостерігався у пацієнтів із серповидноклітинною анемією.
Терапія ВІЛ
Відомо, що люди з мутацією CCR5-Δ32 (делеція 32 нуклеотидів у гені CCR5) стійкі до ВІЛ-інфекції. Якщо обидві копії гена мутовані, вірус не може проникнути в клітини.
Вчені використали цей факт: перед пересадкою кісткового мозку пацієнтам з ВІЛ та лейкозом клітини донора редагували за допомогою CRISPR, «вимикаючи» ген CCR5. Таким чином відтворювали природну мутацію. Результат — одночасне лікування і лейкозу, і ВІЛ-інфекції.
Онкологія та інші напрямки
CRISPR активно досліджують для боротьби з раком. Технологія дозволяє:
- Ідентифікувати гени, відповідальні за виживання ракових клітин.
- Модифікувати імунні клітини пацієнта (CAR-T терапія) для ефективнішого знищення пухлин.
- Виявляти та усувати мутації, що призводять до розвитку раку.
Крім того, ведуться дослідження щодо лікування м’язової дистрофії Дюшенна, муковісцидозу, хвороби Гантінгтона, спадкової сліпоти та інших генетичних захворювань.
Головна складність медичного застосування CRISPR — доставка «генетичних ножиць» у потрібні клітини організму. Поки що найуспішніші результати досягнуто з клітинами, які можна вилучити з організму, відредагувати в лабораторії та повернути назад — передусім із клітинами крові та кісткового мозку.
Застосування в сільському господарстві
CRISPR відкриває нові можливості для сільського господарства, дозволяючи створювати рослини та тварин із покращеними характеристиками без внесення чужорідної ДНК.
Рослини
За допомогою CRISPR вже створено:
- Шампіньйони, які не темніють при механічних пошкодженнях (перший CRISPR-продукт, схвалений Міністерством сільського господарства США у 2016 році).
- Томати зі зміненою кількістю розгалужень та розміром плодів.
- Рижій посівний (Camelina sativa) з підвищеним вмістом омега-3 жирних кислот.
- Сорти сої, стійкі до посухи.
Тварини
Серед прикладів CRISPR-редагування тварин:
- Свині з інактивованими ендогенними ретровірусами — для безпечної ксенотрансплантації (пересадки органів від тварин до людини).
- Корови зі зміненим кольором плям (сіро-білі замість чорно-білих) для кращої стійкості до спеки.
- Модельні організми для вивчення генетичних захворювань — миші, щури, рибки даніо-реріо, дрозофіли.
Регулювання
Важливий нюанс: на відміну від класичних ГМО, CRISPR-модифіковані організми не містять чужорідної ДНК. РНК та білки, що використовуються для редагування, деградують у клітині — залишається лише сама мутація. Фактично CRISPR робить те саме, що і природна селекція, але значно швидше.
У США CRISPR-модифіковані організми не класифікуються як ГМО, що спрощує їхнє виведення на ринок. В Європейському Союзі регулювання залишається суворішим, хоча дискусії про перегляд правил тривають.
Етичні питання та випадок Хе Цзянькуя
Потужність CRISPR породжує серйозні етичні питання. Найгостріше з них — редагування геному людських ембріонів, зміни в яких передаються наступним поколінням.
Скандал 2018 року
У листопаді 2018 року китайський вчений Хе Цзянькуй оголосив, що створив перших у світі генетично відредагованих дітей. Він працював з ембріонами від пар, де батько був ВІЛ-інфікованим, і намагався за допомогою CRISPR «вимкнути» ген CCR5, щоб зробити дітей стійкими до ВІЛ.
У результаті народилося троє зовні здорових дітей. Однак експеримент мав серйозні проблеми:
- Неповне редагування. У однієї дівчинки лише одна копія гена була частково відредагована (делеція 15 нуклеотидів замість потрібних 32), а друга копія залишилася без змін. Захист від ВІЛ не був досягнутий.
- Ризик офф-таргетних мутацій. CRISPR може вносити зміни не лише в цільову ділянку, а й в інші місця геному. Передбачити всі наслідки неможливо.
- Відсутність медичної необхідності. Завдяки сучасним препаратам понад 90% ВІЛ-інфікованих матерів народжують здорових дітей. Ризик експерименту не був виправданий.
- Порушення етичних норм. Хе Цзянькуй підробив дозвіл етичної комісії.
Вчений був засуджений до трьох років ув’язнення та штрафу в розмірі приблизно 430 тисяч доларів. Наукова спільнота одностайно засудила цей експеримент.
Міжнародна позиція
У 2015 році Дженніфер Даудна ініціювала конференцію провідних генетиків у Долині Напа (Каліфорнія), за результатами якої було опубліковано меморандум у журналі Science. Документ закликав заборонити клінічне застосування редагування геному ембріонів людини, доки не будуть зрозумілі наслідки та розроблені правила.
Наразі в більшості країн світу редагування геному людських ембріонів з метою народження дітей заборонено. Дослідження на ембріонах дозволені лише в окремих випадках і під суворим контролем етичних комісій.
Майбутнє технології CRISPR
Технологія CRISPR не стоїть на місці. Вчені постійно вдосконалюють її, розширюючи можливості та підвищуючи безпеку.
Нові покоління «генетичних ножиць»
- Base editing (редагування основ). Модифікований Cas9 (без здатності різати ДНК) з’єднаний з ферментом, який змінює окремі «літери» ДНК без розриву обох ниток. Це значно безпечніше.
- Prime editing. Ще точніший метод, який дозволяє вставляти, видаляти або замінювати невеликі фрагменти ДНК без двониточкового розриву. Його називають «пошук і заміна» для геному.
- CRISPRi та CRISPRa. Модифікації, що дозволяють «вимикати» або «вмикати» гени без зміни самої послідовності ДНК — через вплив на епігеном.
Редагування епігеному
Вчені навчилися використовувати CRISPR для впливу на епігенетичні процеси — метилування ДНК та модифікацію гістонів. Це дозволяє регулювати активність генів, не змінюючи їхню послідовність. Такий підхід може бути безпечнішим для терапевтичного застосування.
Діагностика захворювань
CRISPR використовують не лише для редагування, а й для діагностики. Біосенсори на основі CRISPR/Cas здатні виявляти специфічні послідовності ДНК та РНК збудників інфекцій — включно з коронавірусом SARS-CoV-2 — протягом 15–30 хвилин.
Перспективи
У найближчі роки очікується:
- Розширення списку схвалених CRISPR-терапій для генетичних захворювань.
- Розвиток методів доставки CRISPR-компонентів безпосередньо в органи та тканини.
- Впровадження CRISPR-модифікованих сільськогосподарських культур для підвищення продовольчої безпеки.
- Створення нових діагностичних платформ для швидкого виявлення інфекцій.
CRISPR/Cas9 — це не просто лабораторний інструмент. Це технологія, яка вже змінює медицину, сільське господарство та фундаментальну науку. Її потенціал порівнюють з відкриттям антибіотиків або винаходом комп’ютера.
Часті запитання (FAQ)
Що означає абревіатура CRISPR?
CRISPR розшифровується як Clustered Regularly Interspaced Short Palindromic Repeats — кластери регулярно розташованих коротких паліндромних повторів. Це особливі ділянки ДНК бактерій, які зберігають інформацію про віруси, що раніше атакували клітину.
Чи безпечний CRISPR для людини?
Технологія CRISPR має високу точність, але не є абсолютно безпомилковою. Існує ризик так званих офф-таргетних мутацій — ненавмисних змін в інших ділянках геному. Саме тому клінічне застосування проходить суворі випробування, а редагування ембріонів людини заборонене в більшості країн.
Чи є CRISPR-модифіковані продукти в магазинах?
У США деякі CRISPR-модифіковані продукти вже дозволені до продажу — наприклад, шампіньйони, що не темніють, та соя, стійка до посухи. В Європі регулювання суворіше, і такі продукти поки що не представлені на ринку.
Чим CRISPR відрізняється від ГМО?
Класичні ГМО містять чужорідну ДНК з інших організмів. CRISPR-редагування може вносити зміни без додавання чужої ДНК — лише модифікуючи існуючі гени. Результат аналогічний природним мутаціям, але досягається значно швидше.
Скільки коштує CRISPR-експеримент?
Базові CRISPR-реагенти коштують від 10 до 20 євро. Для порівняння: попередні технології редагування генів (ZFN, TALEN) вимагали створення індивідуальних білків вартістю кілька тисяч євро. Доступність CRISPR зробила генну інженерію масовою.
Чи можна за допомогою CRISPR створити «суперлюдину»?
Теоретично CRISPR дозволяє змінювати будь-які гени, але на практиці складні ознаки (інтелект, зовнішність, здібності) визначаються сотнями генів та впливом середовища. Наука поки не має достатніх знань, щоб «запрограмувати» такі ознаки. Крім того, подібні експерименти заборонені міжнародними нормами.
Хто отримав Нобелівську премію за CRISPR?
У 2020 році Нобелівську премію з хімії отримали Еммануель Шарпентьє (Франція/Німеччина) та Дженніфер Даудна (США) «за розробку методу редагування геному». Це була перша Нобелівська премія з природничих наук, присуджена виключно двом жінкам.