- CRISPR/Cas9 — як працюють молекулярні ножиці, що переписують генетичний код
- Що таке CRISPR/Cas9: суть технології
- Принцип роботи CRISPR/Cas9: покроковий механізм
- Крок 1: Створення напрямної РНК
- Крок 2: Пошук мішені в геномі
- Крок 3: Розрізання ДНК
- Крок 4: Репарація та редагування
- Чому саме Cas9 став стандартом
- Як CRISPR/Cas9 знаходить потрібний ген серед мільярдів «літер»
- Нецільові ефекти: головний ризик CRISPR/Cas9
- Як мінімізувати нецільові ефекти
- Доставка Cas9 у клітину: ключовий технічний бар’єр
- Три формати доставки Cas9
- Методи доставки в організм
- Застосування CRISPR/Cas9 у медицині
- Лікування спадкових захворювань крові
- Боротьба з онкологічними захворюваннями
- Лікування спадкових захворювань in vivo
- Перспективні клінічні напрямки
- CRISPR/Cas9 у сільському господарстві
- Безпека CRISPR/Cas9: що говорить наука
- Нецільові мутації
- Хромосомні перебудови
- Імунна відповідь
- Етика редагування генів: де проходить межа
- Регулювання CRISPR/Cas9 у світі
- Що приходить на зміну класичному Cas9
- Base editing — редагування окремих «літер»
- Prime editing — «пошук і заміна»
- Альтернативні нуклеази
- Майбутнє CRISPR/Cas9: горизонти 2025–2030
- Ключові цифри про CRISPR/Cas9
- Часті запитання про CRISPR/Cas9
- Чим CRISPR/Cas9 відрізняється від попередніх методів редагування генів?
- Чи можна вилікувати спадкову хворобу за допомогою CRISPR/Cas9?
- Чи небезпечний CRISPR/Cas9?
- Чи можна за допомогою CRISPR/Cas9 створити «дизайнерських дітей»?
- Скільки коштує лікування CRISPR/Cas9?
- Чому CRISPR/Cas9 важливий для кожного
CRISPR/Cas9 — як працюють молекулярні ножиці, що переписують генетичний код
Білок розміром у 160 кілодальтон знаходить одну конкретну послідовність серед 3,2 мільярда пар нуклеотидів і розрізає її з точністю до однієї «літери». Це не фантастика. Це CRISPR/Cas9 — інструмент, який за десять років пройшов шлях від бактеріальної імунної системи до Нобелівської премії та першого схваленого генного препарату.
У першій статті ми розповіли, що таке CRISPR і чому він змінив правила гри. У другій — зануривлися в механізми редагування геному. Тепер час розібратися в головному герої цієї революції — білку Cas9. Як саме він працює? Чому саме він став стандартом? І що приходить йому на зміну?
Що таке CRISPR/Cas9: суть технології
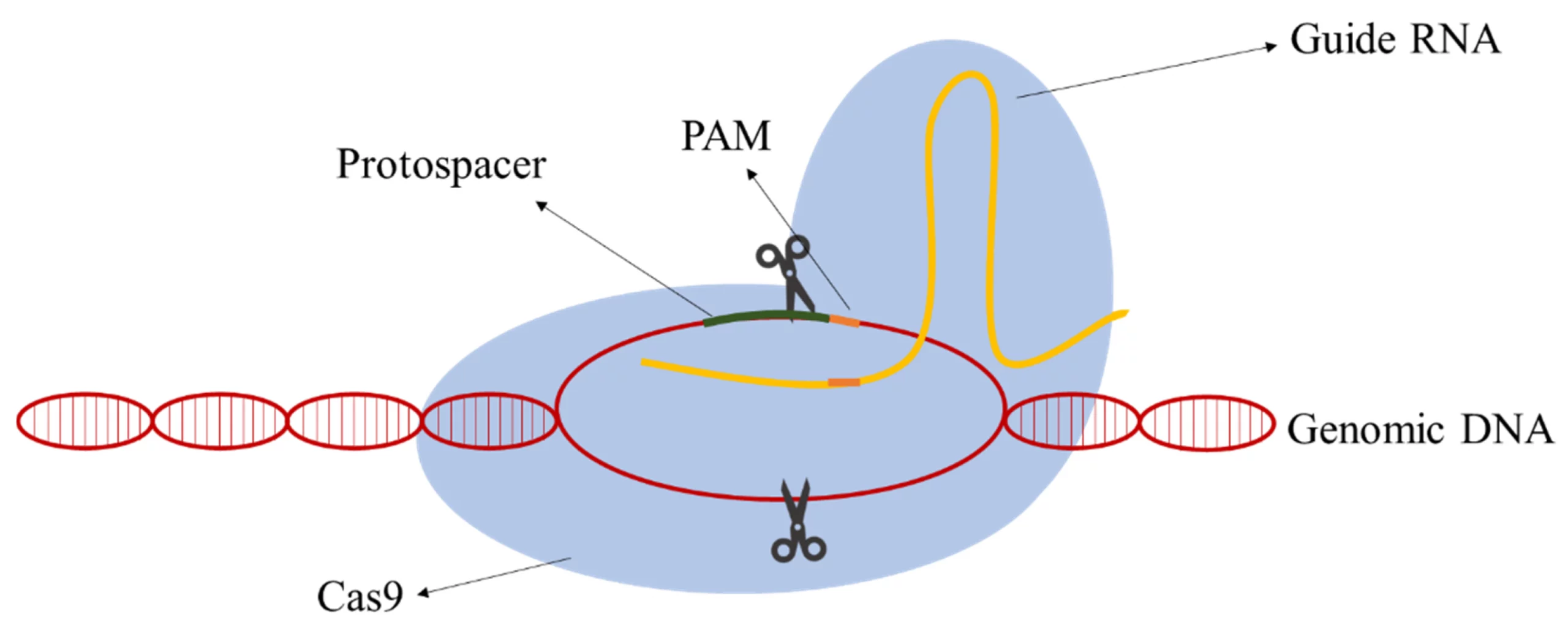
CRISPR/Cas9 — це система редагування генів, яка складається з двох компонентів: напрямної РНК (guide RNA) та білка-ферменту Cas9. Напрямна РНК знаходить потрібну ділянку ДНК, а Cas9 розрізає її. Після розрізу клітина сама «лагодить» пошкодження, і саме в цей момент вчені можуть внести потрібні зміни.
Назва CRISPR розшифровується як Clustered Regularly Interspaced Short Palindromic Repeats — «короткі паліндромні повтори, регулярно розташовані групами». Cas9 — це CRISPR-associated protein 9, тобто «білок, асоційований із CRISPR, номер 9». Разом вони утворюють систему, яку часто називають «генетичними ножицями».
Простими словами: якщо ДНК — це книга з 3,2 мільярда літер, то напрямна РНК — це закладка, яка вказує на потрібне слово, а Cas9 — це ножиці, які його вирізають. Після цього можна вставити нове слово, видалити старе або замінити одну літеру на іншу.
Принцип роботи CRISPR/Cas9: покроковий механізм
Механізм дії CRISPR/Cas9 складається з чотирьох послідовних етапів. Кожен із них критично важливий для точного та безпечного редагування.
Крок 1: Створення напрямної РНК
Усе починається з напрямної РНК (gRNA — guide RNA). Це штучно синтезована молекула довжиною приблизно 20 нуклеотидів, яка комплементарна (точно відповідає) тій ділянці ДНК, яку потрібно відредагувати. Вчені проєктують gRNA за допомогою біоінформатичних програм, які аналізують геном і підбирають оптимальну послідовність із мінімальним ризиком нецільових збігів.
Напрямна РНК складається з двох частин: crRNA (CRISPR RNA), яка розпізнає мішень, та tracrRNA (trans-activating CRISPR RNA), яка зв’язується з білком Cas9. У сучасних лабораторіях ці дві частини зазвичай об’єднують в одну молекулу — sgRNA (single guide RNA), що спрощує роботу.
Крок 2: Пошук мішені в геномі
Комплекс Cas9 + gRNA сканує ДНК, ковзаючи вздовж подвійної спіралі. Білок Cas9 «розплітає» невеликі ділянки ДНК і перевіряє, чи збігається послідовність із напрямною РНК. Цей процес відбувається з вражаючою швидкістю — комплекс перевіряє тисячі ділянок за секунду.
Однак Cas9 не активується при будь-якому збігу. Поруч із мішенню має бути коротка послідовність PAM (Protospacer Adjacent Motif). Для найпоширенішого варіанту Cas9 зі Streptococcus pyogenes (SpCas9) PAM-послідовність — це NGG, де N — будь-який нуклеотид. PAM виконує роль «перевірки безпеки»: без неї фермент не розріже ДНК, навіть якщо gRNA знайшла збіг.
Крок 3: Розрізання ДНК
Коли мішень знайдена і PAM підтверджена, Cas9 змінює свою конформацію (просторову структуру) та активує два каталітичних домени:
- Домен RuvC — розрізає один ланцюг ДНК (некомплементарний до gRNA)
- Домен HNH — розрізає другий ланцюг (комплементарний до gRNA)
Результат — подвійний розрив (Double-Strand Break, DSB) обох ланцюгів ДНК. Це серйозне пошкодження, яке клітина негайно намагається відремонтувати. Саме механізм репарації визначає, що станеться далі.
Крок 4: Репарація та редагування
Після подвійного розриву клітина активує один із двох основних механізмів репарації:
- NHEJ (Non-Homologous End Joining) — негомологічне з’єднання кінців. Клітина просто «зшиває» розрізані кінці. Цей процес неточний: він часто вносить невеликі вставки або видалення нуклеотидів (інделі). Результат — ген «ламається» і перестає працювати. Це називають нокаутом гена
- HDR (Homology-Directed Repair) — репарація за гомологією. Якщо вчені надають клітині шаблон із правильною послідовністю, клітина використає його як зразок для ремонту. Це дозволяє точно замінити мутантну послідовність на нормальну — нокін
NHEJ активний протягом усього клітинного циклу, тому він переважає. HDR працює переважно у фазі S та G2, коли клітина готується до поділу. Саме тому точна вставка нових послідовностей залишається технічно складнішою задачею, ніж вимкнення гена.
Чому саме Cas9 став стандартом
У природі існують десятки різних Cas-білків. Чому саме Cas9 зі Streptococcus pyogenes став головним інструментом генної інженерії? Для цього є кілька вагомих причин.
Простота програмування. Щоб перенацілити Cas9 на нову ділянку ДНК, достатньо змінити послідовність напрямної РНК — коротку молекулу з 20 нуклеотидів. Це можна зробити за кілька годин і за $30–50. Попередні технології (ZFN, TALEN) вимагали створення нового білка для кожної мішені, що займало тижні та коштувало тисячі доларів.
Висока ефективність. SpCas9 демонструє високу активність у клітинах різних організмів — від бактерій до людини. Ефективність редагування в оптимальних умовах досягає 70–90% для нокауту генів.
Мультиплексність. Cas9 можна одночасно використовувати з кількома напрямними РНК для редагування декількох генів за один раз. Це критично важливо для складних проєктів — наприклад, для створення свиней-донорів органів, де потрібно одночасно інактивувати десятки генів.
| Характеристика | ZFN | TALEN | CRISPR/Cas9 |
|---|---|---|---|
| Вартість на одну мішень | $5 000 – $10 000 | $1 000 – $3 000 | $30 – $50 |
| Час підготовки | Місяці | Тижні | Дні |
| Мультиплексне редагування | Дуже складно | Складно | Відносно просто |
| Розмір білка | ~300 амінокислот на пару | ~950 амінокислот | 1 368 амінокислот (SpCas9) |
| Механізм розпізнавання | Білок-ДНК | Білок-ДНК | РНК-ДНК |
Головна перевага CRISPR/Cas9 — це демократизація генної інженерії. Технологія, яка раніше була доступна лише кільком десяткам лабораторій у світі, тепер працює в тисячах дослідницьких центрів. Кількість наукових публікацій із використанням CRISPR зросла з кількох десятків у 2012 році до понад 20 000 щорічно.
Як CRISPR/Cas9 знаходить потрібний ген серед мільярдів «літер»
Одне з найчастіших питань: як маленька молекула РНК знаходить одну конкретну послідовність серед 3,2 мільярда пар нуклеотидів? Відповідь криється у фізиці молекулярних взаємодій.
Комплекс Cas9-gRNA не «читає» весь геном послідовно. Замість цього він використовує стратегію тривимірної дифузії та одновимірного ковзання. Білок випадково стикається з ДНК, перевіряє наявність PAM-послідовності (NGG), і якщо PAM знайдена — розплітає невелику ділянку ДНК для перевірки комплементарності з gRNA.
Оскільки PAM-послідовність NGG зустрічається в геномі людини приблизно кожні 8 нуклеотидів, Cas9 перевіряє мільйони потенційних сайтів. Але повна комплементарність із 20-нуклеотидною gRNA — подія статистично рідкісна. Ймовірність випадкового збігу 20 нуклеотидів поспіль становить приблизно 1 до 1012, що значно перевищує розмір геному.
Увесь процес пошуку займає від кількох хвилин до кількох годин in vitro. У живій клітині швидкість залежить від концентрації комплексу Cas9-gRNA та доступності хроматину.
Нецільові ефекти: головний ризик CRISPR/Cas9
Жоден інструмент не є ідеальним. Найбільша проблема CRISPR/Cas9 — нецільові мутації (off-target effects). Це ситуації, коли Cas9 розрізає ДНК не лише у запланованому місці, а й у схожих послідовностях в інших частинах геному.
Чому це відбувається? Напрямна РНК толерантна до невеликих невідповідностей. Якщо в геномі є ділянка, яка відрізняється від мішені лише на 1–3 нуклеотиди, Cas9 може розрізати і її. Наслідки варіюються від нешкідливих до потенційно небезпечних — включаючи порушення роботи важливих генів або активацію онкогенів.
Як мінімізувати нецільові ефекти
За останнє десятиліття вчені розробили кілька ефективних стратегій:
- Високоточні варіанти Cas9 — eSpCas9, HiFi Cas9, Cas9-HF1. Ці модифіковані ферменти мають знижену здатність зв’язуватися з неідеально комплементарними послідовностями, що зменшує кількість помилок у 10–100 разів
- Скорочені gRNA — зменшення довжини напрямної РНК з 20 до 17–18 нуклеотидів парадоксально підвищує специфічність. Коротша РНК менш толерантна до невідповідностей
- Використання нікази — модифікований Cas9 (Cas9n), у якого інактивовано один каталітичний домен. Він розрізає лише один ланцюг ДНК. Два Cas9n із різними gRNA, спрямованими на сусідні ділянки, створюють подвійний розрив лише при одночасному спрацюванні обох — що різко знижує ймовірність нецільового ефекту
Крім того, сучасні біоінформатичні інструменти — такі як Cas-OFFinder, CRISPOR та GUIDE-seq — дозволяють заздалегідь передбачити потенційні нецільові сайти та обрати gRNA з мінімальним ризиком помилок.
Доставка Cas9 у клітину: ключовий технічний бар’єр
Створити ідеальний інструмент — лише половина справи. Потрібно ще доставити його до потрібних клітин в організмі. Проблема доставки залишається одним із найбільших технічних викликів на шляху до широкого клінічного застосування CRISPR/Cas9.
Три формати доставки Cas9
Компоненти CRISPR/Cas9 можна доставити в клітину у трьох форматах, кожен із яких має свої переваги:
- Плазмідна ДНК — ген Cas9 та gRNA вбудовані у плазміду (кільцеву молекулу ДНК). Клітина сама синтезує білок і РНК. Перевага — простота виробництва. Недолік — тривала експресія Cas9 збільшує ризик нецільових ефектів
- мРНК + gRNA — матрична РНК Cas9 та напрямна РНК доставляються безпосередньо. Клітина транслює мРНК у білок. Перевага — тимчасова експресія, менший ризик інтеграції в геном
- Рибонуклеопротеїновий комплекс (RNP) — готовий білок Cas9, вже зв’язаний із gRNA. Перевага — найшвидша дія та найкоротший час перебування в клітині, що мінімізує нецільові ефекти. Це найбезпечніший формат для клінічного застосування
Методи доставки в організм
Для доставки CRISPR-компонентів у клітини живого організму використовують кілька основних підходів:
Адено-асоційовані віруси (AAV) — невеликі віруси, які ефективно проникають у клітини, але мають обмежену ємність (близько 4,7 кілобаз ДНК). Ген SpCas9 займає 4,2 кілобази, тому залишається мало місця для інших компонентів. Для вирішення цієї проблеми використовують менші варіанти Cas9 — наприклад, SaCas9 зі Staphylococcus aureus (3,2 кілобази).
Ліпідні наночастинки (LNP) — штучні «бульбашки» з ліпідів, які інкапсулюють мРНК Cas9 та gRNA. Ця технологія добре зарекомендувала себе під час пандемії COVID-19 для доставки мРНК-вакцин. Компанія Intellia Therapeutics використовує LNP для доставки CRISPR у клітини печінки та вже продемонструвала зниження рівня мутантного білка транстиретину на 87–93% в клінічних випробуваннях.
Електропорація — короткі електричні імпульси створюють тимчасові пори в клітинній мембрані, через які проникають компоненти CRISPR. Цей метод використовують для редагування ex vivo — коли клітини вилучають з організму, редагують у лабораторії та повертають назад. Саме так працює Casgevy — перший схвалений CRISPR-препарат.
Застосування CRISPR/Cas9 у медицині
Медицина — найочікуваніший і найвідповідальніший напрямок застосування CRISPR/Cas9. Технологія вже перейшла від лабораторних досліджень до реальних клінічних результатів.
Лікування спадкових захворювань крові
У грудні 2023 року FDA (США) та MHRA (Велика Британія) схвалили Casgevy (exa-cel) — перший у світі лікарський препарат на основі CRISPR/Cas9. Він призначений для лікування серпоподібноклітинної анемії та бета-таласемії — тяжких спадкових захворювань крові, від яких страждають мільйони людей по всьому світу.
Принцип дії: у пацієнта відбирають стовбурові клітини крові, за допомогою CRISPR/Cas9 «вмикають» ген фетального гемоглобіну (HBG1/HBG2), який зазвичай неактивний після народження, і повертають клітини в організм. Відредаговані клітини починають виробляти функціональний гемоглобін. Клінічні дані вражають: 97% пацієнтів із серпоподібноклітинною анемією не мали больових кризів протягом щонайменше 12 місяців після лікування.
Боротьба з онкологічними захворюваннями
CRISPR/Cas9 відкриває нові можливості в імуноонкології. Технологію активно використовують для вдосконалення CAR-T терапії — методу, при якому Т-лімфоцити пацієнта генетично модифікують для розпізнавання та знищення пухлинних клітин.
За допомогою CRISPR/Cas9 вчені одночасно вносять кілька змін у Т-клітини: додають рецептор для розпізнавання пухлини, видаляють гени, які гальмують імунну відповідь (наприклад, PD-1), та підвищують стійкість клітин до імуносупресивного середовища пухлини. Це робить CAR-T терапію ефективнішою та потенційно доступнішою.
Лікування спадкових захворювань in vivo
Компанія Intellia Therapeutics проводить клінічні випробування CRISPR-терапії для лікування транстиретинового амілоїдозу. Одноразова ін’єкція ліпідних наночастинок із CRISPR-компонентами доставляє Cas9 безпосередньо в клітини печінки. Результат — зниження рівня мутантного білка на 87–93%.
Це перший приклад успішного застосування CRISPR/Cas9 in vivo — безпосередньо в організмі пацієнта, без вилучення клітин. Результати відкривають шлях до лікування десятків інших захворювань.
Перспективні клінічні напрямки
Станом на 2025 рік у світі зареєстровано понад 80 клінічних випробувань із застосуванням CRISPR-терапій. Серед найперспективніших напрямків:
- ВІЛ-інфекція — видалення провірусної ДНК, інтегрованої в геном людини. Компанія Excision BioTherapeutics проводить клінічні випробування першої фази
- Спадкова сліпота — редагування мутацій, що спричиняють амавроз Лебера. Компанія Editas Medicine досліджує in vivo підхід із субретинальною ін’єкцією
- М’язова дистрофія Дюшенна — видалення або виправлення мутацій у гені дистрофіну. Кілька компаній перебувають на доклінічній стадії
CRISPR/Cas9 у сільському господарстві
Медицина — найгучніший, але далеко не єдиний напрямок. CRISPR/Cas9 трансформує сільське господарство, дозволяючи створювати нові сорти рослин за місяці замість десятиліть традиційної селекції.
Ключова перевага: у багатьох випадках CRISPR-модифіковані рослини не містять чужорідної ДНК. Вчені лише «вимикають» або коригують власні гени рослини. Тому в США, Японії, Аргентині та Бразилії такі рослини не підпадають під регулювання ГМО, що суттєво прискорює їх вихід на ринок.
Приклади вже комерціалізованих CRISPR-продуктів:
- Помідори Sicilian Rouge High GABA (Японія, 2021) — містять у 4–5 разів більше амінокислоти GABA, яка сприяє зниженню кров’яного тиску
- Соя з підвищеним вмістом олеїнової кислоти (США) — здоровіша олія з покращеним жирнокислотним профілем
- Пшениця зі зниженим вмістом глютену — потенційне рішення для людей із целіакією
У перспективі CRISPR/Cas9 може допомогти створити культури, стійкі до посухи, засолення ґрунтів та нових хвороб. Це критично важливо в умовах зміни клімату та зростання населення планети до прогнозованих 9,7 мільярда до 2050 року.
Безпека CRISPR/Cas9: що говорить наука
Питання безпеки — одне з найважливіших для будь-якої медичної технології. CRISPR/Cas9 не є винятком. Ось основні ризики, які досліджує наукова спільнота.
Нецільові мутації
Як ми вже обговорили, Cas9 може розрізати ДНК у небажаних місцях. Для клінічного застосування це неприйнятно. Тому кожна CRISPR-терапія проходить ретельний аналіз нецільових ефектів за допомогою методів повногеномного секвенування — таких як GUIDE-seq, CIRCLE-seq та DISCOVER-seq.
Хромосомні перебудови
Подвійний розрив ДНК — це серйозне пошкодження. У рідкісних випадках він може призвести до великих хромосомних перебудов: делецій (втрати великих фрагментів), транслокацій (переміщення фрагментів між хромосомами) або хромотрипсису (масивної фрагментації хромосоми). Ці ризики є одним із аргументів на користь base editing та prime editing, які не створюють подвійних розривів.
Імунна відповідь
Білок Cas9 — бактеріального походження. Дослідження показали, що значна частина людей має вже існуючий імунітет до SpCas9, оскільки Streptococcus pyogenes — поширений патоген людини. Імунна відповідь може знизити ефективність терапії або спричинити побічні ефекти. Для вирішення цієї проблеми досліджують Cas9 з інших видів бактерій, менш поширених серед людей.
Етика редагування генів: де проходить межа
Потужність CRISPR/Cas9 породжує серйозні етичні питання. Найгостріша дискусія точиться навколо редагування геному людських ембріонів — змін, які передаватимуться наступним поколінням.
Наукова спільнота чітко розрізняє два типи редагування:
- Соматичне редагування — зміни в клітинах тіла дорослої людини. Не передаються нащадкам. Більшість вчених та регуляторів підтримують цей підхід для лікування тяжких захворювань
- Зародкове редагування — зміни в яйцеклітинах, сперматозоїдах або ембріонах. Передаються всім наступним поколінням. У більшості країн діє фактичний мораторій
Справа Хе Цзянькуя у 2018 році стала переломним моментом. Китайський вчений використав CRISPR/Cas9 для редагування ембріонів, що призвело до народження перших генетично модифікованих дітей. Наукова спільнота засудила цей експеримент: технологія не була достатньо безпечною, існували альтернативні методи захисту від ВІЛ, а довгострокові наслідки невідомі. Хе Цзянькуй був засуджений до трьох років ув’язнення.
Ключові етичні питання, на які суспільство ще не має однозначних відповідей:
- Де межа між лікуванням спадкового захворювання та «покращенням» людини?
- Хто матиме доступ до генних терапій, якщо вони коштуватимуть мільйони?
- Як запобігти створенню «дизайнерських дітей» з обраними ознаками?
- Чи має людство право змінювати геном майбутніх поколінь?
У 2021 році Експертний комітет ВООЗ опублікував рекомендації щодо управління редагуванням геному людини, закликаючи до відповідального використання технології та міжнародного співробітництва у сфері регулювання.
Регулювання CRISPR/Cas9 у світі
Різні країни по-різному підходять до регулювання технологій генного редагування. Єдиного міжнародного стандарту поки не існує.
| Країна/регіон | Підхід до CRISPR-рослин | Зародкове редагування людини |
|---|---|---|
| США | Не регулюються як ГМО, якщо не містять чужорідної ДНК | Заборонено фінансування з федерального бюджету |
| ЄС | Регулюються як ГМО (рішення Суду ЄС, 2018) | Заборонено у більшості країн |
| Японія | Не регулюються як ГМО при відсутності чужорідної ДНК | Заборонено клінічне застосування |
| Китай | Регулювання в процесі розробки | Заборонено після справи Хе Цзянькуя |
| Велика Британія | Після Brexit — власне регулювання, більш ліберальне, ніж у ЄС | Дозволено лише для досліджень (до 14 днів) |
Відсутність єдиного регулювання створює ризик «регуляторного арбітражу» — коли дослідники переміщуються до країн із менш суворими правилами. Це одна з причин, чому міжнародна спільнота працює над створенням глобальних стандартів.
Що приходить на зміну класичному Cas9
Класичний CRISPR/Cas9 — це лише перший крок. За останнє десятиліття вчені створили цілий арсенал інструментів нового покоління, кожен із яких вирішує конкретні задачі точніше та безпечніше.
Base editing — редагування окремих «літер»
У 2016 році група Девіда Лю з Гарвардського університету створила base editors — інструменти, які хімічно перетворюють одну нуклеотидну основу на іншу без подвійного розриву ДНК. Два типи — CBE (C→T) та ABE (A→G) — разом можуть виправити близько 60% усіх відомих патогенних точкових мутацій у людини.
Prime editing — «пошук і заміна»
У 2019 році та сама група представила prime editing — найточніший інструмент на сьогодні. Він використовує модифікований Cas9 (ніказа) та спеціальну РНК (pegRNA), яка одночасно вказує мішень і містить шаблон для редагування. Теоретично prime editing може виправити до 89% відомих генетичних варіантів, пов’язаних із захворюваннями.
Альтернативні нуклеази
Крім SpCas9, вчені досліджують десятки інших CRISPR-асоційованих білків:
- Cas12a (Cpf1) — менший за розміром, розпізнає інші PAM-послідовності (TTTV), створює «липкі» кінці замість «тупих». Розширює діапазон доступних мішеней
- Cas13 — розрізає РНК замість ДНК. Використовується для діагностики (системи SHERLOCK) та потенційно — для боротьби з РНК-вірусами
- CasX та CasY — компактні білки, відкриті в некультивованих бактеріях. Їхній менший розмір полегшує доставку за допомогою вірусних векторів
Майбутнє CRISPR/Cas9: горизонти 2025–2030
Технологія CRISPR/Cas9 розвивається стрімко. Ось напрямки, які визначатимуть найближче майбутнє.
Нові схвалені терапії. Очікується реєстрація CRISPR-препаратів для лікування транстиретинового амілоїдозу, спадкового ангіоневротичного набряку та інших захворювань. Десятки терапій перебувають на різних стадіях клінічних випробувань.
In vivo редагування. Перехід від ex vivo підходу (вилучення клітин → редагування → повернення) до прямого редагування в організмі. Це зробить терапію доступнішою та менш інвазивною.
Ксенотрансплантація. CRISPR-відредаговані свині як джерело донорських органів для людей. Перші контрольовані клінічні випробування можуть розпочатися до 2027 року.
Персоналізована медицина. Індивідуальні CRISPR-терапії, розроблені під конкретного пацієнта та його унікальний набір мутацій. Вартість секвенування геному вже впала нижче $200, що робить генетичну діагностику масово доступною.
Зниження вартості. Лікування Casgevy коштує приблизно $2,2 млн за одного пацієнта. Зниження цієї ціни — одне з головних завдань галузі. Нові методи доставки та масштабування виробництва можуть зробити генну терапію доступнішою протягом наступного десятиліття.
Ключові цифри про CRISPR/Cas9
| Показник | Значення |
|---|---|
| Рік створення інструменту CRISPR/Cas9 | 2012 (Шарпентьє та Дудна) |
| Нобелівська премія з хімії | 2020 (Шарпентьє та Дудна) |
| Перший схвалений CRISPR-препарат | Casgevy (exa-cel), грудень 2023 |
| Розмір білка SpCas9 | 1 368 амінокислот (~160 кДа) |
| Довжина напрямної РНК | ~20 нуклеотидів |
| PAM-послідовність SpCas9 | NGG |
| Ефективність нокауту | 70–90% в оптимальних умовах |
| Вартість одного експерименту | Від $30–50 |
| Клінічні випробування CRISPR (2025) | Понад 80 |
| Ефективність Casgevy | 97% без больових кризів (≥12 міс.) |
| Вартість лікування Casgevy | ~$2,2 млн |
Часті запитання про CRISPR/Cas9
Чим CRISPR/Cas9 відрізняється від попередніх методів редагування генів?
Головна відмінність — простота та вартість. Попередні методи (ZFN, TALEN) вимагали створення нового білка для кожної мішені, що займало тижні-місяці та коштувало тисячі доларів. CRISPR/Cas9 використовує один і той самий білок Cas9, а для перенацілювання достатньо змінити коротку РНК-послідовність. Це займає дні та коштує $30–50.
Чи можна вилікувати спадкову хворобу за допомогою CRISPR/Cas9?
Так, перший CRISPR-препарат Casgevy вже схвалений для лікування серпоподібноклітинної анемії та бета-таласемії. Десятки інших терапій перебувають на стадії клінічних випробувань. Однак не всі генетичні захворювання однаково піддаються лікуванню — ефективність залежить від типу мутації, ураженого органу та можливості доставки CRISPR-компонентів.
Чи небезпечний CRISPR/Cas9?
Як і будь-який потужний інструмент, CRISPR/Cas9 має ризики. Основний — нецільові мутації, коли Cas9 розрізає ДНК у небажаних місцях. Для клінічного застосування кожна терапія проходить ретельну перевірку безпеки. Нові покоління інструментів (base editing, prime editing) значно знижують ці ризики.
Чи можна за допомогою CRISPR/Cas9 створити «дизайнерських дітей»?
Теоретично технологія дозволяє редагувати геном ембріонів. Практично — це заборонено у більшості країн, а наукова спільнота підтримує мораторій на клінічне застосування зародкового редагування. Більшість ознак людини (інтелект, зовнішність, здібності) визначаються сотнями генів та факторами середовища, що робить «дизайн» практично неможливим на сучасному рівні знань.
Скільки коштує лікування CRISPR/Cas9?
Єдиний схвалений препарат Casgevy коштує приблизно $2,2 млн за одного пацієнта. Це дорого, але серпоподібноклітинна анемія потребує довічного лікування, яке за все життя може коштувати ще більше. Очікується, що з розвитком технологій та появою конкуренції вартість знижуватиметься.
Чому CRISPR/Cas9 важливий для кожного
CRISPR/Cas9 — це не абстрактна наука з далеких лабораторій. Це технологія, яка вже змінює життя реальних людей. Пацієнти з серпоподібноклітинною анемією живуть без болю. Фермери отримують нові сорти рослин, стійкі до хвороб та посухи. Діагностичні тести стають швидшими та точнішими.
Але найважливіше — CRISPR/Cas9 ставить перед людством питання, відповіді на які визначать наше майбутнє. Чи маємо ми право переписувати генетичний код? Як забезпечити рівний доступ до генних терапій? Де межа між лікуванням та «вдосконаленням»?
Від того, як суспільство відповість на ці питання, залежить не лише розвиток медицини, а й майбутнє самого людства. І чим більше людей розуміють, як працює CRISPR/Cas9, тим кращими будуть ці відповіді.
Джерела та додаткове читання:
- Doudna, J.A. & Charpentier, E. (2014). The new frontier of genome engineering with CRISPR-Cas9. Science, 346(6213)
- Barrangou, R. & Doudna, J.A. (2016). Applications of CRISPR technologies in research and beyond. Nature Biotechnology
- Anzalone, A.V. et al. (2020). Genome editing with CRISPR–Cas nucleases, base editors, transposases and prime editors. Nature Biotechnology
- What is CRISPR-Cas9? — Yourgenome.org